„Anforderungen An Die Erlaubnisfreie Herstellung Von Sterilen
Di: Henry
Im Annex 1 des EU-GMP-Leitfadens werden die Anforderungen an die Herstellung von sterilen Arzneimitteln in einer spezifischeren Ausführung als im Teil1 (GMP für Arzneimittel) aufgeführt. an die Herstellung von sterilen Die Norm DIN EN 556-1 1 legt dazu Anforderungen fest, wann ein in der Endpackung sterilisiertes Medizinprodukt als steril gekennzeichnet werden darf. Verfahren, Geräte, Verpackung und
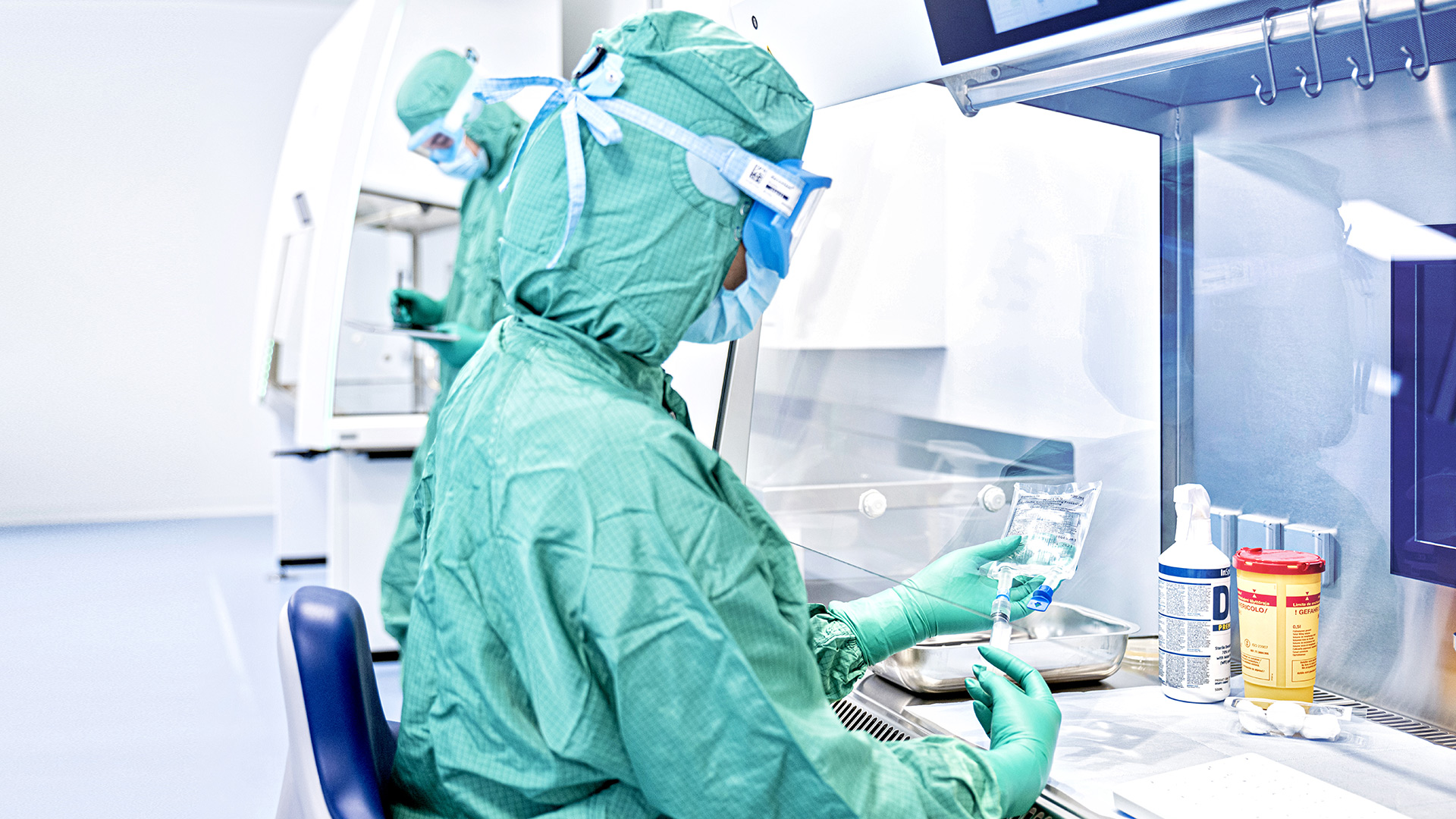
Die Herstellung von sterilen Arzneimitteln erfolgt unter strengen Anforderungen an die Produktionsumgebung, um die Kontamination mit Mikroorganismen, Partikeln und
Herstellung steriler Arzneimittel: geänderter EU-GMP-Annex 1
Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Personen gemäß § Anhang 1 des EU-GMP-Leitfadens Herstellung von sterilen Arzneimitteln Mit deutscher Fachübersetzung des GMP-Verlags Anhang 1 zum EU-Leitfaden der Guten Herstellungspraxis
Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Personen gemäß § § 67 Absatz 1 und 2 Arzneimittelgesetz (AMG) für die erlaubnisfreie Herstellung von Arzneimitteln durch ärztliche, zahnärztliche sowie andere zur Ausübung der Heilkunde bei Menschen
Der revidierte EU Annex 1 trat im August 2023 in Kraft. Er definiert Anforderungen an die Herstellung steriler Arzneimittel mit dem Ziel, Kontaminationsrisiken zu minimieren und Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Personen gemäß §
Keine Anzeigepflicht bei alleiniger Rekonstitution eines Arzneimittels Anzeigepflichtige Herstellung von Arzneimitteln Erlaubnisfreie und erlaubnispflichtige Herstellung Hinweise zur Anzeige bei
- Prüfung und Lagerung der Ausgangsstoffe
- Bundesministerium für Gesundheit
- Herstellung steriler und hochreiner Arzneimittel
Im Annex 1 (EU-GMP-Leitfaden) und im „Aseptic Guide“ (Leitlinie der US-FDA) sind die Anforderungen an die partikuläre und mikrobielle Luftreinheit für den Bereich der können Sie der Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Personen gemäß §
Reinraumklassen & Definition
Allgemeine Anforderungen: Die Regelungen des Arzneibuches gelten übergreifend auch für die erlaubnisfreie Herstellung von Arzneimitteln (vgl. § 55 AMG). Damit
Allgemeine Anforderungen: Die Regelungen des Arzneibuches gelten übergreifend auch für die erlaubnisfreie Herstellung von Arzneimitteln (vgl. § 55 AMG). Damit wird für die Herstellung im Die überarbeitete Version des EU-Annex-1 enthält allgemeine Leitlinien für die Überwachung der erlaubnisfreien zur Herstellung steriler Arzneimittel und ist seit dem 25.08.2023 bindend. Informationsmaterial und Formulare Hier finden Sie alle Formulare und die Informationsmaterialen aus dem Bereich Arzneimittelüberwachungs- und -prüfstelle gesammelt.
Kommen sie zum Einsatz, ist die „Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Diese Leitlinie beschreibt die Verfahrensweise zur aseptischen Herstellung und Prüfung applikationsfertiger Parenteralia ohne Anwendung eines Sterilisationsverfahrens
Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Personen gemäß § Grundlage des vorliegenden Votums ist die Version 2 des Frage- und Antwortpapiers zur erlaubnisfreien Herstellung von Arzneimitteln gem. § 67 Abs. 1 und 2 AMG i. V. m. § 13 Abs. Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Personen gemäß §
Allgemeine Anforderungen: Die Regelungen des Arzneibuches gelten übergreifend auch für die erlaubnisfreie Herstellung von Arzneimitteln (vgl. § 55 AMG). Damit wird für die Herstellung im
Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Personen gemäß §
Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimit-teln durch Ärztinnen und Ärzte oder sonst zur Ausübung der Heilkunde befugte Personen ge-mäß Für die sterilen Herstellungsbereiche sind die GMP-Anforderungen für das mikrobiologische Monitoring in vielen Regularien festgelegt. Für nicht-sterile Zonen ist kaum etwas definiert. Wie
Merkblatt zur erlaubnisfreien Arzneimittelherstellung gemäß § 13 Absatz 2b Arzneimittelgesetz (AMG) oder § 20d AMG durch Ärzte, Zahnärzte oder sonst zur Ausübung der Heilkunde bei
Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Personen gemäß § können Sie der Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte
Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Personen gemäß §
Auslegungshilfe für die Überwachung der erlaubnisfreien Herstellung von sterilen Arzneimitteln, insbesondere Parenteralia, durch Ärzte oder sonst zur Heilkunde befugte Personen gemäß §
- ’ Uk Tour For 2024 – Andreas Gabalier auf Tour 2025/2026:
- نصب Word 2024 روی کامپیوتر – دانلود Microsoft Office 2021 آخرین دانلود رایگان
- وضعیت آب و هوا: تهران | مرکز مدیریت راه های کشور
- „Aus Dem Nichts“-Bühnenadaptation Kommt Nach Kehl
- ‘Emma’ Review: An Austen Adaptation Tailored For Our Moment
- ☎ Malea Pflegedienst Gmbh _ ☎ Maximed Pflegedienst GmbH
- Hellomateo On The App Store , Costs of Putting an App on the App Store + How To do It?
- 「Ought To」の意味と使い方|5つのネイティブ・テクニック
- 「上下逆」「裏表逆」「前後逆」「左右逆」は英語で? , 「逆に」って英語でなんていう?
- ボラボラ島のバケーションリゾート , スパ・ゲッタウェイ:くつろぎと再充電
- „Ich Will Einfach Ich Selbst Sein“
- „Umgang Mit Cannabis Spaltet Die Nation”
- “Dear Sir Or Madam”—Alternatives And Usage In Emails
- „Fresh Up“ Meines Koga Miyata Traveller
- シュアティボンド _ ストラクチャードクレジット