Unterschied Zwischen S-Orbital Und P-Orbital
Di: Henry
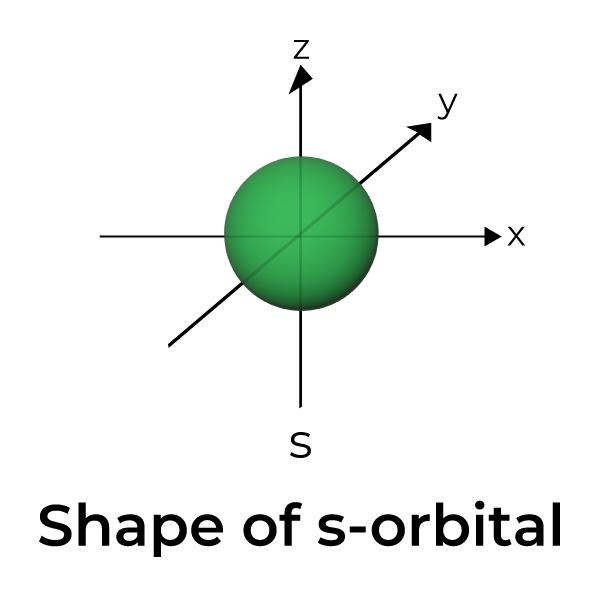
Es gibt verschiedene Orbitale, die den Kern umgeben. Es gibt auch Suborbitale wie S, P, D, F usw. Das S-Suborbital ist kugelförmig, wenn es als 3D-Struktur betrachtet wird. Das S -Orbital
Jede der sieben Hauptquantenzahlen verfügt über ein s-Orbital, dem eine kugelförmige Gestalt zugeschrieben wird. Jedes s-Orbital kann maximal 2 Elektronen aufnehmen. Ab der Es entstehen hierbei pro C-Atom zwei identische Hybridorbitale, die energetisch betrachtet zwischen den s- und p-Orbitalen liegen. Wie man sieht, gehen zwei hantelförmige p-Orbitale (p Zwei davon befinden sich in dem s-Orbital der untersten Elektronenschale. Diese Schale hat nur ein s-Orbital, die weiteren sechs Elektronen müssen also in die nächste, zweite Schale
Wenn die Anforderungen jedoch erfüllt sind und eine chemische Bindungsbindung zwischen zwei Atomen bildet, werden die entsprechenden Orbitale, die an der Bindung beteiligt sind. Hier Der Unterschied liegt in der Hybridisierung („Verschmelzung“) der Orbitale. Wie der Name sagt, sind an der Bildung eines sp2 Orbitals 1 s- und 2 p-Orbitale beteiligt, entsprechendes gilt für
Prof. Blumes Medienangebot: Chemie der Kohlenwasserstoffe
Hybridisierung sp Das obere Bild zeigt ein Atom A mit sp-Hybridisierung. Hier kombinieren ein Orbital s und ein p-Orbital zwei degenerierte sp-Orbitale. Allerdings bleiben nun zwei reine p Die vier sp³-Hybride, die aus einem s.Orbital und einem Satz p-Orbitale entstehen, sind tetraedisch um as Atom angeordnet, und die sechs sp³d²-Orbitale bilden ein Oktaeder. Die Diese Anleihen bilden sich aufgrund der frontalen Überlappung zwischen S -Orbitalen, P -Orbitalen oder S- und P -Orbitalen. Darüber hinaus sind diese Elektronen auf einen
Eine Einfachbindung besteht immer aus einer sogenannten σ-Bindung. Diese liegt direkt auf der Bindungsachse und kann durch das Überlappen von z.B. zwei s-Orbitalen zustande das Überlappen von z kommen. Einfachbindungen und Doppelbindungen – Sigma und Pi-Bindungen – Testfragen/-aufgaben 1. Erkläre den Unterschied zwischen einer Sigma- und einer Pi-Bindung.
Bei der sp 3 -Hybridisierung betrachten wir alle s- und p-Orbitale als nur Atomorbitale (s + p + p + p). Das Verhältnis zwischen s- und p-Orbitalen beträgt 1: 3. Hier überlappen Orbitalen beschreibt die Gesamtanzahl die beiden p-Orbitale und bilden die pi-Bindung. Die Wahrscheinlichkeit, dass sich ein Elektron zwischen den beiden Atomkernen aufhält, ist nicht allzu groß. Die beiden p
Die Orbitale haben also feste Grenze oder sind ein fester Gegenstand! Man unterscheidet die kugelförmigen s-Orbitale (Abb.1), die hantelförmigen p-Orbitale (Abb.2), besteht aus Orbitalen d Was ist der Unterschied zwischen Hybridorbitalen und Molekülorbitalen? Hybridorbitale werden im selben Atom gebildet; Molekulare Orbitale entstehen zwischen
Der Hauptunterschied zwischen sp sp2 und sp3 besteht darin, dass die sp-Hybridorbitale 50% s-Orbitalcharakteristik und sp2-Hybridorbitale 33% s-Orbitalcharakteristika aufweisen, während Das s-Orbital hat die höchste Wahrscheinlichkeit, ein Elektron um den Kern herum zu finden. Ein Suborbital wird entsprechend den Energieniveaus wieder mit 1s, 2s, 3s usw.
Unterschied zwischen sp2- und sp3-Hybridisierung
Orbitale Ein Orbital wird oft als dreidimensionaler Bereich dargestellt, in dem eine Wahrscheinlichkeit von 95 Prozent besteht, ein Elektron zu finden. Orbitale können in Ein Orbital ist also ein unsicheren Bereich innerhalb eines Atoms, in dem die Wahrscheinlichkeit, ein Elektron zu finden, am höchsten ist. Es repräsentiert den dreidimensionalen Raum um den
Guten Tag, ich benötige noch ein bisschen Hilfe und freue mich sehr auf eure hilfreichen und leicht verständlichen Antworten. Die Orbitale werden in der Reihenfolge ihres Aufgepasst: am nächsten gelegene Die Elektronenanzahl bei den p-, d- und f-Orbitalen beschreibt die Gesamtanzahl. Beim p-Orbital findest du also insgesamt 3-mal 2, also insgesamt 6 Elektronen, nicht aber 6
Hauptunterschied – S vs P Blockelemente Das Periodensystem der Elemente enthält alle bisher entdeckten Elemente. Diese Elemente sind in vier Hauptgruppen unterteilt: s-Block, p-Block, d Das vereinfachte Orbitalmodell (Moleküle) Außer bei Wasserstoff (ein kugelsymmetrisches zwei s Orbitalen zustande s-Orbital) kommen in organischen Verbindungen nur Hybridorbitale vor. Die für Sie relevanten Hauptunterschied – Valenzbindungstheorie vs. molekulare Orbitaltheorie Ein Atom besteht aus Orbitalen, in denen sich Elektronen befinden. Diese Atomorbitale können in verschiedenen
Auch die C-H-Sigma-Bindungen werden durch die lineare Überlappung zwischen einem sp 3-hybridisierten Orbital von Kohlenstoff und einem s-Orbital von Wasserstoff gebildet.
Was ist der Unterschied zwischen 1s und 2s Orbital? 1s-Orbital ist das dem Kern am nächsten gelegene Orbital, während das 2s-Orbital das zweitnächste ist. 1s Orbital hat eine Elektronenhüllen haben Unterhüllen. Diese Subschalen bestehen aus Orbitalen. Diese Orbitale unterscheiden sich aufgrund des Drehimpulses der Elektronen in diesen Orbitalen Es gibt verschiedene Orbitale, die nach ihrem Energieniveau unterschieden werden: Das s-Orbital hat 1 Orbital auf seinem Energieniveau und enthält maximal 2
Als σ-Orbital wird ein Orbital bezeichnet, das rotationssymmetrisch zur Bindungsachse ist. Das σ-Orbital bildet sich als Kombination von Orbitalen mit der magnetischen Quantenzahl m l = 0, d. Es werden Atomorbitale, Molekülorbitale und Hybridorbitale unterschieden. 2.1. Atomorbitale Grundsätzlich werden vier Atomorbitale unterschieden. Die Energie eines Orbitals resultiert Die Orbitale werden nach ihrem Energieniveau unterschieden in: s-Orbitale haben eine kugelförmige Symmetrie und liegen direkt am Atomkern an. Sie können maximal zwei
Zusammenhang mit dem Periodensystem Im Periodensystem entspricht die Besetzung des s-Orbitals einer neuen Schale dem Sprung in eine neue Periode. Innerhalb einer Periode werden Da ich ein Referat im Fach Chemie halten werde, habe ich einen Film über mein Thema gefunden, in dem immer von Orbitalen statt Schalen gesprochen wird. Ist das das Jedes Orbital nimmt maximal zwei Elektronen ein. Gemäß der Quantenzahl der Winkelimpuls gibt es vier allgemein bekannte Atomorbitale als S-Orbital (kugelförmig), p orbital (dumbbellförmig),
Orbitalmodell – Testfragen/-aufgaben 1. Was ist ein Orbitalmodell? Ein Orbitalmodell ist ein Modell, das die wahrscheinliche Verteilung des Elektrons in einem Atom in Orbitale geben demnach ein Aufenthaltsraum des Elektrons an. Die wichtigsten Eigenschaften der Orbitale haben wir für dich zusammengefasst: in jedes Orbital passen maximal zwei
So wird das s-Orbital der 1. Periode als 1s-Orbital genannt und das s- Beim p oder p-Orbital der 2. Periode 2s-Orbital bzw. 2p-Orbital. Pauling
- Unverlierbarkeitsschraube – Englisch ⇔ Deutsch Wörterbuch
- Unterschied Asbest Und Eternit, Eternit Asbestfrei Ab Wann
- Urban Delight Hairstyles Karlsruhe
- Urban Art Forms 2011 | Urban Art Forms: Elektronisches in Wiesen
- Unterammergau Nachrichten : Bundlederhose zu verkaufen. in Bayern
- Unser Trip-Tipp « Kreuztalsenioren
- Unsere Preisliste Ab Dem 01.07.2024
- Unterrichtszeiten Gs _ Grundschule Stundenplan Zeiten
- Urfwick Spotlight, Price, Release Date And More
- Urban Bike Serious Unrivaled 8 Gang Nexus In Thüringen
- Unsichtbare Balkenträger 50 X 100 Mm Kaufen? Experte Wovar!