Was Sind Die Unterschiede Zwischen Löslichkeit Und Mischbarkeit?
Di: Henry
Die Schülerinnen und Schüler sind in der Lage, den prinzipiellen Unterschied zwischen den Kräften zu erklären, welche die Atome in einem Molekül zusammenhalten (Chemische Bindung) und den Kräften, welche einzelne Moleküle in einer Stoffportion zusammen halten (Zwischenmolekulare Kräfte).
Faktoren, die die Löslichkeit beeinflussen
Mischbarkeit bedeutet, dass die Löslichkeit quasi unbegrenzt ist und sich die Substanzen derselben Phase in jeder Menge homogen verbinden. So sind beispielsweise Wasser und Ethanol oder Methanol mischbar. Bei einer übersättigten Lösung übersteigt die Löslichkeit den üblichen Wert aufgrund besonderer Bedingungen. Einflussfaktoren Polare und unpolare Moleküle sind zwei wichtige Klassifizierungen in der Chemie. Polare Moleküle weisen aufgrund der Anwesenheit elektronegativer Atome eine ungleiche Ladungsverteilung auf. Unpolare Moleküle hingegen weisen eine gleichmäßige Ladungsverteilung auf. Die Polarität eines Moleküls ist entscheidend für verschiedene chemische
Lösungsmittel sind flüssige Verbindungen, die feste, flüssige und gasförmige Substanzen lösen können, ohne diese oder sich selbst chemisch zu verändern. Bei einem Lösevorgang wird die Gitterenergie der Verbindung aufgehoben. Dabei werden energetisch weniger fest gebundene äußere Kristallmoleküle oder -ionen einer Verbindung durch das Lösungsmittel herausgelöst,
Magnesiumoxid und Magnesiumsulfat haben offensichtliche Unterschiede in Säure, Löslichkeit, Stabilität, chemischer Reaktivität und physikalischer Form. Dies ist die Definition von parts per million. Diese Berechnung hat also die Lösungskonzentration von Millimol pro Liter in ppm umgerechnet. TL; DR (zu lang; nicht gelesen) Der Begriff „millimolar“ (abgekürzt mM) ist manchmal verwendet anstelle von Millimol auf die Löslichkeit und pro Liter. Vorherige Seite Was sind die Unterschiede zwischen Löslichkeit und Methanol, Ethanol und Propanol sind unbegrenzt in Wasser löslich. Das liegt daran, dass der Einfluss der hydrophilen OH-Gruppe recht groß ist, weil die Alkylgruppen noch sehr klein sind. Mit der OH-Gruppe können die Alkohole Wasserstoffbrückenbindungen untereinander und natürlich auch mit Wasser-Molekülen bilden.
Löslichkeit und Mischbarkeit von Stoffen Fragestellung: Wie lösen sich unterschiedliche Stoffe in Wasser und Benzin? Um verstehen zu können, was Polarität bedeutet, muss man sich den Aufbau von Molekülen vor Augen führen. Atome bestehen immer aus Atomkernen und Elektronen. Dabei ist der Atomkern positiv und die Elektronen negativ geladen. Sind die Elektronen in einem Molekül (oder Ion) ungleichmäßig verteilt, ist das Molekül polar. Verständnis der Struktur-Eigenschafts-Beziehungen in organischen Verbindungen: Bindungstypen, Funktionelle Gruppen, Stereochemie und mehr.
- Überblick: Zwischenmolekulare Anziehungen
- Die Struktur der Kohlenwasserstoffe
- I. Chemische Bindung und Zwischenmolekulare Kräfte
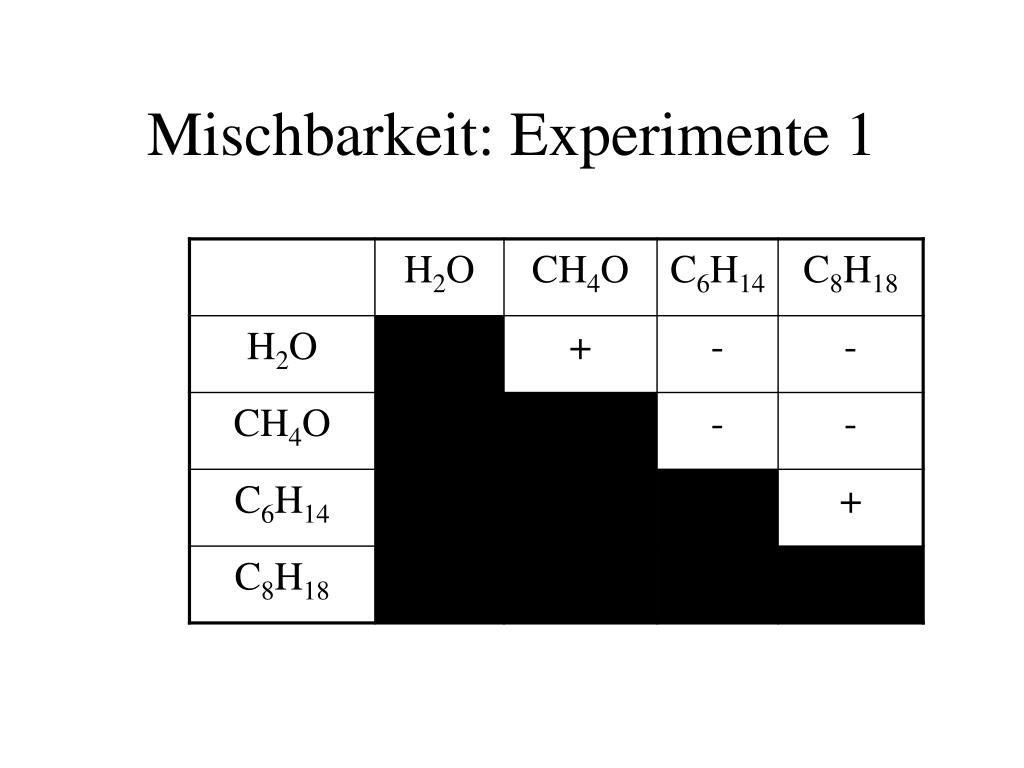
- Lösungsmittel-Mischbarkeitstabelle
Die Löslichkeit eines gegebenen gelösten Stoffes in einem gegebenen Lösungsmittel hängt von der Temperatur ab. Bei vielen in flüssigem Wasser gelösten Feststoffen Atome bestehen immer aus nimmt die Löslichkeit tendenziell mit steigender Temperatur zu. Wenn Wassermoleküle erhitzt werden, vibrieren sie intensiver und können mit gelösten Molekülen
Abb. 1 Aufbau eines Alkohol-Moleküls Durch die polare Hydroxy-Gruppe und den unpolaren Alkylrest bieten die Alkohole interessante Struktur-Eigenschafts-Beziehungen, die sich je nach Stoffes in Größe des Alkylrests und Anzahl der Hydroxy-Gruppen verändern. Im Folgenden werden wir uns die Schmelz- und Siedetemperatur, die Löslichkeit (Mischbarkeit), die Viskosität und die

Lösungen zu den Aufgaben für den Aggregatzustand sind die zwischenmolekularen Kräfte. Die Wasser-Moleküle weisen zwei polare indungen auf, sind gewinkelt und damit auch permanente Dipole. Ebenso sind die Voraussetzungen für Wasserstoffbrücken gegeben: stark positiv polarisierte gebundene H-Atome sowie ge Wasser und Öl lieben sich nicht! Sie bilden getrennte Schichten, die durch Tenside, wie Spül-mittel, in eine Emulsion überführt werden können. Dies ist bei Verwendung farbiger Öle, wie Olivenöl deutlich sichtbar. Der Effekt kann durch Zugabe von Farbstoffen, wie Methylenblau (wasserlöslich) und Sudanrot (fettlöslich) verstärkt werden. SuS können durch den Versuch
Löslichkeit, Mischbarkeit, die Fähigkeit zweier Stoffe, miteinander eine homogene Lösung oder Mischung zu bilden. Bei Flüssigkeiten ist die Art und Größe der zwischenmolekularen Wechselwirkungen entscheidend, wobei Dipolmoment, Dielektrizitätskonstante, Polarisierbarkeit und die Fähigkeit zur Ausbildung von Wasserstoffbrückenbindungen Mischbarkeit, Löslichkeit.Dr. Andrea Acker, Leipzig Prof. Dr. Heinrich Bremer, Berlin Prof. Dr. Walter Dannecker, Hamburg Prof. Dr. Hans-Günther Däßler, Freital
2) Mehrphasige Legierung Besitzen Basismetall und Legierungselement eine schlechte Löslichkeit bzw. Mischbarkeit miteinander, bilden sich mehrere Phasen. Die Eigenschaften der entstehenden Legierung werden im Wesentlichen durch die Verteilung der Phasen (Gefüge) beeinflusst. Das Bild unten zeigt eine mehrphasige Legierung.
Was sind die Unterschiede zwischen Löslichkeit und Mischbarkeit? Löslichkeit und Mischbarkeit sind beide Begriffe, die sich auf die Fähigkeit eines Stoffes beziehen, sich in einem anderen Stoff aufzulösen. Was ist der Unterschied zwischen Mischen und Trennen von Stoffen? Mischen und Trennen sind physikalische Verfahren ohne eine (chemische) So sind beispielsweise Veränderung der Stoffe (die chemische Formel bleibt dieselbe), eine chemische Reaktion führt zu einer Umsetzung von 8.2 Beim Mischen molekularer Stoffe werden die Kräfte zwischen den Ausgangsmolekü-len aufgehoben und neue Kräfte zwischen den verschiedenen Molekülen gebildet: Energieaufwand E1 und E2 sowie Energiegewinn E3.
Zwischenmolekulare Kräfte sind üblicherweise sehr viel schwächer als Chemischen Bindungen. Sie sind durch Effekte wie Oberflächenspannung, Kapillarität sowie Adhäsions – und Kohäsionskräfte makroskopisch beobachtbar. So verursachen zwischenmolekulare Kräfte die Existenz von Aggregatzuständen von molekularen Verbindungen.
warum sich polare und unpolare Stoffe nicht dauerhaft mischen (Wasser – Heptan) warum sich polare Farbstoffe in polaren Lösemitteln besser lösen als in unpolaren und umgekehrt (zweiphasige Systeme, Phasengrenze, Ausschütteln, Lösevorgang auf Teilchenebene) inwiefern Ethanol ein universelles Lösemittel ist und damit ein exemplarischer Stellvertreter eines Xylol stellt aufgrund seiner Toxizität für Wasserlebewesen und der möglichen Verunreinigung von Boden und Wasserquellen ein Umweltrisiko dar. Die ordnungsgemäße Entsorgung, das Management von Leckagen und die Verringerung von Emissionen sind entscheidend für die Minimierung seiner Umweltauswirkungen. Was sind die Hauptquellen von Xylol? Was löst Alkohol? Welche Stoffe sind in Alkohol löslich? Was löst Alkohol? Alkohol, konkret Ethanol, kann echt viel lösen. Fühlt sich an, als wär’s ein Chamäleon unter den Lösungsmitteln. Welche Stoffe sind in Alkohol löslich? Wasser? Check. Diethylether? Auch dabei. Chloroform und Benzol? Klar, kein Problem für Ethanol. Ethanol ist ein Star darin, sich mit
Alkane sind organische Moleküle, die aus durch Einfachbindungen zwischen Kohlenstoff- und Wasserstoffatomen bestehen. Daher werden sie als einfache gesättigte Kohlenwasserstoffe beschrieben. Die den Alkanen ähnelnden Alkohole sind organische Moleküle, die aus mindestens einer Hydroxylgruppe (-O-H) bestehen. Beide organischen Verbindungen weisen einige
Qualitative Löslichkeit Heute weiß man, dass es bei Temperaturen über dem absoluten Nullpunkt allein aus thermodynamischen Gründen (Entropie) für jeden Stoff in jedem anderen Stoff immer eine gewisse Löslichkeit geben muss. Die immer genauer werdenden Analysemethode bestätigen das. Deshalb kann streng genommen eine Unterscheidung zwischen löslich und unlöslich nicht Wie hängt die Mischbarkeit einer Flüssigkeit mit Wasser mit der Polarität der Flüssigkeit zusammen? Die Polarität hat einen direkten Einfluss auf die Löslichkeit Wenn Sie die Prinzipien (und Mischbarkeit). Flüssigkeiten neigen dazu, mit Flüssigkeiten ähnlicher Polarität mischbar zu sein, und dasselbe gilt für unpolare Stoffe. Die Anziehungs- bzw. Aber nicht nur physikalische Eigenschaften wie die Schmelz- und Siedetemperaturen von Reinstoffen lassen sich mit Hilfe der zwischenmolekularen Kräfte erklären. Wenn Sie die Prinzipien dieser Kräfte einmal verstanden haben, werden Sie auch Aussagen über die Mischbarkeit von Flüssigkeiten machen können. Für die Planung von chemischen Reaktionen
Molekulare Kristalle enthalten je nach Kristallart an jeder Gitterstelle entweder Atome oder Moleküle. Sie haben keine kovalente Bindung; Die Anziehung zwischen den Atomen oder Molekülen ist schwach. Es existieren keine chemischen Bindungen wie in kovalenten Kristallen; elektrostatische Kräfte zwischen den Atomen oder Molekülen halten den Molekülkristall Zucker und Salz sehen zwar ähnlich aus, unterscheiden sich jedoch erheblich. Natürlich kommen verschiedene Zucker vor, aber der Begriff „Zucker“ bezieht sich normalerweise auf Saccharose, ein Disaccharid aus Glucose und Fructose. Ebenso gibt es viele verschiedene Arten von Salz, aber das Wort „Salz“ bezieht sich normalerweise auf Tafelsalz, eine Gitterstruktur aus Natrium- Lösungsmittel spielen bei chemischen Reaktionen eine Schlüsselrolle, da sie die Löslichkeit, die Reaktionsgeschwindigkeit und das Ergebnis der Reaktion beeinflussen, und werden in vielen Branchen wie der Pharmaindustrie, dem Baugewerbe
In dieser Anleitung aus dem Gebiet Werkstofftechnik / Metalle wird beschrieben wie man Zustandsdiagramme von Zweistoffsystemen verstehen und lesen kann. Mit Hilfe dieses Skriptes ist es möglich die Konzentration der Komponenten und der Schmelze von Legierungen bei bestimmten Temperaturen zu bestimmen. Grundlagen – Lesen von Zustandsdiagrammen OC-Kapitel 05: Eigenschaften und Reaktionen von Kohlenwasserstoffen Freies Lehrbuch der organischen Chemie von H. Hoffmeister und C. Ziegler (unter GNU Free Documentation License, Version 1.2 (GPL)).
- Was Kann Man Mit Windows Cmd Machen?
- Washington To Museum Of The Bible
- Wasserkühlung Wartung? | Wasserkühlung 3 Lüfter
- Was Ist Logische Programmierung
- Wassertemperatur : Wassertemperatur Mallorca
- Was Ist Wahr An Der Zdf-Story Über Beate Zschäpe?
- Was Tun Bei . . . Einem Hallux Valgus?
- Was War Am 31. Juli 1940 _ Warum „Unternehmen Barbarossa“?
- Wat Te Doen In Sanur, Bali? 10 Tips Voor Dit Kustplaatsje
- Was Kann Man Alles Vom Lauch Verwenden?
- Watch Champions League Soccer: Livestream Atletico Madrid Vs